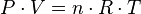Soluciones (o disoluciones) químicas |
Una solución (o disolución) es una mezcla de dos o más componentes, perfectamente homogénea ya que cada componente se mezcla íntimamente con el otro, de modo tal que pierden sus características individuales. Esto último significa que los constituyentes son indistinguibles y el conjunto se presenta en una sola fase (sólida, líquida o gas) bien definida.
Una solución que contiene agua como solvente se llama solución acuosa.
Si se analiza una muestra de alguna solución puede apreciarse que en cualquier parte de ella su composición es constante.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida. Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Entonces, reiterando, llamaremos solución o disolución a las mezclas homogéneas que se encuentran en fase líquida. Es decir, las mezclas homogéneas que se presentan en fase sólida, como las aleaciones (acero, bronce, latón) o las que se hallan en fase gaseosa (aire, humo, etc.) no se les conoce como disoluciones.
Las mezclas de gases, tales como la atmósfera, a veces también se consideran como soluciones.
Las soluciones son distintas de los coloides y de las suspensiones en que las partículas del soluto son de tamaño molecular y están dispersas uniformemente entre las moléculas del solvente.
Las sales, los ácidos, y las bases se ionizan cuando se disuelven en el agua
Características de las soluciones (o disoluciones):
I) Sus componente no pueden separarse por métodos físicos simples como decantación, filtración, centrifugación, etc.
II) Sus componentes sólo pueden separase por destilación, cristalización, cromatografía.
III) Los componentes de una solución son soluto y solvente.
soluto es aquel componente que se encuentra en menor cantidad y es el que se disuelve. El soluto puede ser sólido, líquido o gas, como ocurre en las bebidas gaseosas, donde el dióxido de carbono se utiliza como gasificante de las bebidas. El azúcar se puede utilizar como un soluto disuelto en líquidos (agua).
solvente es aquel componente que se encuentra en mayor cantidad y es el medio que disuelve al soluto. El solvente es aquella fase en que se encuentra la solución. Aunque un solvente puede ser un gas, líquido o sólido, el solvente más común es el agua.
IV) En una disolución, tanto el soluto como el solvente interactúan a nivel de sus componentes más pequeños (moléculas, iones). Esto explica el carácter homogéneo de las soluciones y la imposibilidad de separar sus componentes por métodos mecánicos.
Mayor o menor concentración
Ya dijimos que las disoluciones son mezclas de dos o más sustancias, por lo tanto se pueden mezclar agregando distintas cantidades: Para saber exactamente la cantidad de soluto y de solvente de una disolución se utiliza una magnitud denominada concentración.
Dependiendo de su concentración, las disoluciones se clasifican en diluidas, concentradas, saturadas, sobresaturadas.
Diluidas: si la cantidad de soluto respecto del solvente es pequeña. Ejemplo: una solución de 1 gramo de sal de mesa en 100 gramos de agua.
Concentradas: si la proporción de soluto con respecto del solvente es grande. Ejemplo: una disolución de 25 gramos de sal de mesa en 100 gramos de agua.
Saturadas: se dice que una disolución está saturada a una determinada temperatura cuando no admite más cantidad de soluto disuelto. Ejemplo: 36 gramos de sal de mesa en 100 gramos de agua a 20º C.
Si intentamos disolver 38 gramos de sal en 100 gramos de agua, sólo se disolvería 36 gramos y los 2 gramos restantes permanecerán en el fondo del vaso sin disolverse.
Sobresaturadas: disolución que contiene mayor cantidad de soluto que la permitida a una temperatura determinada. La sobresaturación se produce por enfriamientos rápidos o por descompresiones bruscas. Ejemplo: al sacar el corcho a una botella de refresco gaseoso.
Modo de expresar las concentraciones
Ya sabemos que la concentración de las soluciones es la cantidad de soluto contenido en una cantidad determinada de solvente o solución. También debemos aclarar que los términos diluida o concentrada expresan concentraciones relativas.
Las unidades de concentración en que se expresa una solución o disolución pueden clasificarse en unidades físicas y enunidades químicas.
¿Qué tipo de solución son las aleaciones?
Cuando se mezclan dos sólidos entre sí se producen, entre otras soluciones, las aleaciones.
Las partículas de las sustancias que se disuelven tienen dimensiones moleculares que oscilan entre 1 milimicrón y 0,01 milimicrón.
El agua corriente es una solución en la que se hallan disueltos minerales, aire y sales.
Las partículas de las sustancias que se disuelven tienen dimensiones moleculares que oscilan entre 1 milimicrón y 0,01 milimicrón.
El agua corriente es una solución en la que se hallan disueltos minerales, aire y sales.
Unidades químicas de concentración
Para expresar la concentración de las soluciones se usan también sistemas con unidades químicas, como son:
a) Fracción molar
b) Molaridad M = (número de moles de soluto) / (1 litro de solución)
c) Molalidad m = (número de moles de soluto) / (1 kilo de solvente)
a) Fracción molar (Xi): se define como la relación entre los moles de un componente (ya sea solvente o soluto) de la solución y los moles totales presentes en la solución.
Ejercicio:
Se agregan 3 gramos de sal en una cacerola con 4 litros de agua ¿cuál es la concentración de sal?, o dicho de otra forma ¿cuál es la concentración de la solución?
Calcular la fracción molar de solvente y de soluto: Recordemos que la fracción molar expresa la concentración de una solución en Moles de Soluto o de Solvente por Moles Totales de la Solución.
Solvente: agua (H2O)
Soluto: sal (NaCl)
Datos que conocemos: 3 gramos de soluto y 4.000 cm3 (4 litros) de solvente.
Con estos datos debemos resolver el problema, calculando 4 valores significativos: moles de solvente, moles de soluto, fracción molar de solvente y fracción molar de soluto.
Para el agua, se conoce su masa molar = M(H2O) = 18 g/mol (1 mol de H2O contiene 18 g, formados por 2 g de H y 16 g de O).
Averiguar cuántos moles de solvente H2O) tenemos:
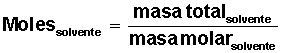
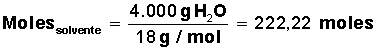
Para la sal (NaCl) su masa molar = M(NaCl) = 58,5 g/mol (1 mol de sal equivale a 58,5 g, formados por 23 g de Na y 35,5 g de Cl)
Averiguar cuántos moles de soluto tenemos:
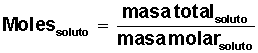
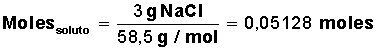
Ahora que conocemos la cantidad de moles de solvente y la cantidad de moles de soluto, podemos calcular las fracciones molares de solvente y de soluto:
Fracción molar del solvente = Xsolvente
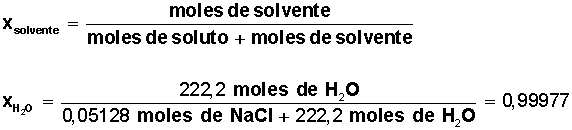
Fracción molar del solvente (agua) = 0,99977
Fracción molar del soluto= Xsoluto

Fracción molar del soluto= 0,00023
Pero sabemos que:
Entonces: 0,99977 + 0,00023 = 1
b) Molaridad (M): Es el número de moles de soluto contenido en un litro de solución. Una solución 4 molar (4 M) es aquella que contiene cuatro moles de soluto por litro de solución.
Ejercicio:
¿Cuál será la molaridad de una solución que contiene 64 g de Metanol (masa molar del metanol 32 gr/mol) en 500 ml de solución?
Datos conocidos: metanol 64 g
Masa molar del metanol: 32 g/mol
Masa de la solución: 500 ml (0,5 litro)
Primero calculamos la cantidad de moles que hay en 64 g de metanol.
Si un mol de metanol equivale a 32 g, 64 g equivalen a 2 moles (64/32=2)
Aplicamos la fórmula:
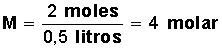
Respuesta: 4 molar
c) Molalidad
En primer lugar debemos advertir que molalidad no es lo mismo que molaridad por lo cual debemos evitar confundirlas puesto que el nombre es muy parecido pero en realidad cambian mucho los cálculos, y es un grave error pero muy frecuente.
En la molalidad relacionamos la molaridad del soluto con el que estamos trabajando con la masa del disolvente (en kg) que utilizamos.
La definición de molalidad es la siguiente:
Relación entre el número de moles de soluto por kilogramos de disolvente (m)

Unidades físicas de concentración
Las unidades físicas de concentración están expresadas en función del peso y del volumen, en forma porcentual, y son las siguientes:
a) Tanto por ciento peso/peso %P/P = (cantidad de gramos de soluto) / (100 gramos de solución)
b) Tanto por ciento volumen/volumen %V/V = (cantidad de cc de soluto) / (100 cc de solución)
c) Tanto por ciento peso/volumen % P/V =(cantidad de gr de soluto)/ (100 cc de solución)
a) Porcentaje peso a peso (% P/P): indica el peso de soluto por cada 100 unidades de peso de la solución.

b) Porcentaje volumen a volumen (% V/V): se refiere al volumen de soluto por cada 100 unidades de volumen de la solución.
c) Porcentaje peso a volumen (% P/V): indica el número de gramos de soluto que hay en cada 100 ml de solución.
Ejercicio:
Se tiene un litro de solución al 37%. ¿Cuántos litros de agua se tienen que agregar para que quede al 4%?
Resolvamos:
El problema no indica las unidades físicas de concentración. Se supondrá que están expresadas en % P/V.
Datos que conocemos: V = volumen, C= concentración
V1 = 1 litro
C1 = 37%
37% P/V = significa que hay 37 gramos de soluto en 100 ml de solución (solución = soluto + solvente).
C2 = 4%
V2 = ¿?
Regla para calcular disoluciones o concentraciones
V1 • C1 = V2 • C2
Puede expresarse en: % P/V
Reemplazando los datos que se tienen del problema, se obtiene:
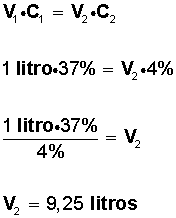
Entonces, si tenemos un litro de solución al 37%; para obtener una solución al 4% es necesario tener un volumen de 9,25 litros; por lo tanto, para saber cuantos litros de agua hay que agregar al litro inicial, hacemos:
V2 – V1 = Volumen de agua agregado
9,25 – 1 = 8,25 litros
Respuesta: Se deben agregar 8,25 litros de agua
Propiedades físicas de las soluciones
Cuando se añade un soluto a un solvente, se alteran algunas propiedades físicas del solvente. Al aumentar la cantidad del soluto, sube el punto de ebullición y el punto de solidificación. Así, para evitar la congelación del agua utilizada en la refrigeracion de los motores de los automóviles, se le añade un anticongelante (soluto). Pero cuando se añade un soluto se rebaja la presión de vapor del solvente.
Otra propiedad destacable de una solución es su capacidad para ejercer una presión osmótica. Si separamos dos soluciones de concentraciones diferentes por una membrana semipermeable (una membrana que permite el paso de las moléculas del solvente, pero impide el paso de las del soluto), las moléculas del solvente pasarán de la solución menos concentrada a la solución de mayor concentración, haciendo a esta última más diluida. Estas son algunas de las características de las soluciones:
- Las partículas de soluto tienen menor tamaño que en las otras clases de mezclas.
- Presentan una sola fase, es decir, son homogéneas.
- Si se dejan en reposo durante un tiempo, las fases no se separan ni se observa sedimentación, es decir las partículas no se depositan en el fondo del recipiente.
- Son totalmente transparentes, es decir, permiten el paso de la luz.
- Sus componentes o fases no pueden separarse por filtración
Clasificación de las soluciones
PÒR SU ESTADO DE
|
POR SU CONCENTRACION
|
SÓLIDAS
|
SOLUCION NO-SATURADA; es aquella en donde la fase dispersa y la dispersante no están en equilibrio a una temperatura dada; es decir, ellas pueden admitir más soluto hasta alcanzar su grado de saturación.
Ej: a 0 ºC 100 g de agua disuelven 37,5 NaCl, es decir, a la temperatura dada, una disolución que contengan 20g NaCl en 100g de agua, es no saturada.
|
LIQUIDAS
|
SOLUCION SATURADA: en estas disoluciones hay un equilibrio entre la fase dispersa y el medio dispersante, ya que a la temperatura que se tome en consideración, el solvente no es capaz de disolver más soluto. Ej una disolución acuosa saturada de NaCl es aquella que contiene 37,5 disueltos en 100 g de agua 0 ºC.
|
GASEOSAS
|
SOLUCION SOBRE SATURADA: representan un tipo de disolución inestable, ya que presenta disuelto más soluto que el permitido para la temperatura dada.
Para preparar este tipo de disoluciones se agrega soluto en exceso, a elevada temperatura y luego se enfría el sistema lentamente. Estas soluciones son inestables, ya que al añadir un cristal muy pequeño del soluto, el exceso existente precipita; de igual manera sucede con un cambio brusco de temperatura.
|
Soluciones acuosas
El agua es la biomolécula más abundante del ser humano, constituye un 65-70 % del peso total del cuerpo. Esta proporción debe mantenerse muy próxima a estos valores para mantener la homeóstasis hídrica, por lo contrario el organismo se ve frente a situaciones patológicas debidas a la deshidratación o la retención de líquidos. La importancia del estudio de la biomolécula agua radica en el hecho de que la totalidad de las reacciones bioquímicas se realizan en el seno del agua, todos los nutrientes se transportan en el seno del agua.
Estructura molecular del agua. Es una molécula tetraédrica, con el atomo de oxigeno en el centro y los dos átomos de hidrogeno en los vértices de dicho tetraedro quedando los otros dos vértices ocupados por los electrones no compartidos del oxígeno
El oxigeno es un átomo que posee mayor electronegatividad que el hidrogeno, esto hace que la molécula de agua sea un dipolo eléctrico. Esta estructura explica muchas de las propiedades físicas y químicas del agua bien sea por la formación de puentes de hidrogeno o por solvatacion de otras moléculas.
Propiedades físicas y químicas del agua. Las propiedades del agua son la base de una serie de funciones esenciales para la integridad del organismo.
De lo anterior se deduce que las funciones bioquímicas y fisiológicas del agua son consecuentes con las propiedades fisicoquímicas que se han estudiado. El agua puede actuar como componente de macromoléculas proteínas, acidos nucleicos, polisacáridos, pueden estabilizar su estructura a través de la formación de puentes de hidrogeno.
El hecho de que sea considerada como disolvente universal de sustancia iónicas, polares no iónicas y anfipáticas, facilita que en su seno se puedan llevar a cabo la totalidad de las reacciones bioquímicas, así como el transporte adecuado de sustancias en el organismo.
El agua puede actuar como sustrato o producto de muchas reacciones como la hidrólisis o formación de ésteres.
El caracter termorregulador del agua, permite conseguir un equilibrio de temperaturas en todo el cuerpo así como la disipación del calor metabólico lo observamos en el ejercicio extenso.
GASES
Se denomina gas el estado de agreghacion de la materia que bajo ciertas condiciones de temperatura y presión permanece en estado gaseoso. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven las moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
Existen diversas leyes derivadas de modelos simplificados de la realidad que relacionan la presion, el volumen y la temperatura de un gas.
Ley de Charles
A una presión dada, el volumen ocupado por una cierta cantidad de un gas es directamente proporcional a su temperatura.
Matemáticamente la expresión sería:
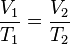 o
o  .
.- Ley de Gay-Lussac
La presión de una cierta cantidad de gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura:
Es por esto que para poder envasar gas, como gas licuado, primero ha de enfriarse el volumen de gas deseado, hasta una temperatura característica de cada gas, a fin de poder someterlo a la presión requerida para licuarlo sin que se sobrecaliente, y, eventualmente, explote.
Ley de los gases ideales
Las tres leyes mencionadas pueden combinarse matemáticamente en la llamada ley general de los gases. Su expresión matemática es:
siendo P la presion, V el volumen, n el número demoles, R la constante universal de los gases ideales y T la temperatura en Kelvin.
El valor de R depende de las unidades que se estén utilizando:
- R = 0,082 atm·l·K−1·mol−1 si se trabaja con atmósferas y litros
- R = 8,31451 J·K−1·mol−1 si se trabaja en Sistema Internacional de Unidades
- R = 1,987 cal·K−1·mol−1
- R = 8,31451 10−10 erg ·K−1·mol−1
- R = 8,317x10−3 (m3)(Kpa)/(mol)(K) si se trabaja con metros cúbicos y kilo pascales
De esta ley se deduce que un mol (10^23) de gas ideal ocupa siempre un volumen igual a 22,4 litros a 0 °C y 1 atmosfera. Véase también volumen molar. También se le llama la ecuación de estado de los gases, ya que solo depende del estado actual en que se encuentre el gas. martin mendoza
Gases reales
Si se quiere afinar más o si se quiere medir el comportamiento de algún gas que escapa al comportamiento ideal, habrá que recurrir a las ecuaciones de los gases reales, que son variadas y más complicadas cuanto más precisas.
Los gases reales no se expanden infinitamente, sino que llegaría un momento en el que no ocuparían más volumen. Esto se debe a que entre sus partículas, ya sean atomos como en los gases nobles o moleculas como en el (O2) y la mayoría de los gases, se establecen unas fuerzas bastante pequeñas, debido a los cambios aleatorios de sus cargas electrostáticas, a las que se llama fuerzas de Van Der Waals.
El comportamiento de un gas suele concordar más con el comportamiento ideal cuanto más sencilla sea su fórmula química y cuanto menor sea su reactividad ( tendencia a formar enlaces). Así, por ejemplo, los gases nobles al ser moléculas monoatómicas y tener muy baja reactividad, sobre todo el helio, tendrán un comportamiento bastante cercano al ideal. Les seguirán los gases diatómicos, en particular el más liviano hidrógeno. Menos ideales serán los triatómicos, como el dióxido de carbono; el caso del vapor de agua aún es peor, ya que la molécula al ser polar tiende a establecer puentes de hidrógeno, lo que aún reduce más la idealidad. Dentro de los gases orgánicos, el que tendrá un comportamiento más ideal será el metano perdiendo idealidad a medida que se engrosa la cadena de carbono. Así, el butano es de esperar que tenga un comportamiento ya bastante alejado de la idealidad. Esto es porque cuanto más grande es la partícula constituyente del gas, mayor es la probabilidad de colisión e interacción entre ellas, factor que hace disminuir la idealidad. Algunos de estos gases se pueden aproximar bastante bien mediante las ecuaciones ideales, mientras que en otros casos hará falta recurrir a ecuaciones reales muchas veces deducidas empíricamente a partir del ajuste de parámetros.
También se pierde la idealidad en condiciones extremas, como altas presiones o bajas temperaturas. Por otra parte, la concordancia con la idealidad puede aumentar si trabajamos a bajas presiones o altas temperaturas. También por su estabilidad química.
Para el comportamiento térmico de partículas de la materia existen cuatro cantidades medibles que son de gran interés: presión,volumen, temperatura y masa de la muestra del material (o mejor aún cantidad de sustancia, medida en moles).
Cualquier gas se considera como un fluido, porque tiene las propiedades que le permiten comportarse como tal.
Sus moléculas, en continuo movimiento, colisionan elásticamente entre sí y contra las paredes del recipiente que contiene al gas, contra las que ejercen una presión permanente. Si el gas se calienta, esta energía calorífica se invierte en energía cinética de las moléculas, es decir, las moléculas se mueven con mayor velocidad, por lo que el número de choques contra las paredes del recipiente aumenta en número y energía. Como consecuencia la presión del gas aumenta, y si las paredes del recipiente no son rígidas, el volumen del gas aumenta.
Un gas tiende a ser activo químicamente debido a que su superficie molecular es también grande, es decir, al estar sus partículas en continuo movimiento chocando unas con otras, esto hace más fácil el contacto entre una sustancia y otra, aumentando la velocidad de reacción en comparación con los líquidos o los sólidos.
Para entender mejor el comportamiento de un gas, siempre se realizan estudios con respecto al gas ideal, aunque éste en realidad nunca existe y las propiedades de este son:
- Una sustancia gaseosa pura está constituida por moléculas de igual tamaño y masa. Una mezcla de sustancias gaseosas está formada por moléculas diferentes en tamaño y masa.
- Debido a la gran distancia entre unas moléculas y otras y a que se mueven a gran velocidad, las fuerzas de atracción entre las moléculas se consideran despreciables.
- El tamaño de las moléculas del gas es muy pequeño, por lo que el volumen que ocupan las moléculas es despreciable en comparación con el volumen total del recipiente. La densidad de un gas es muy baja.
- Las moléculas de un gas se encuentran en constante movimiento a gran velocidad, por lo que chocan elásticamente de forma continua entre sí y contra las paredes del recipiente que las contiene.
Para explicar el comportamiento de los gases, las nuevas teorías utilizan tanto la estadística como la teoría cuántica, además de experimentar con gases de diferentes propiedades o propiedades límite, como el UF6, que es el gas más pesado conocido.
Un gas no tiene forma ni volumen fijo; se caracteriza por la casi nula cohesión y la gran energía cinética de sus moléculas, las cuales se mueven.
Propiedades de los gases |
El estado gaseoso es un estado disperso de la materia, es decir , que las moléculas del gas están separadas unas de otras por distancias mucho mayores del tamaño del diámetro real de las moléculas. Resuelta entonces, que el volumen ocupado por el gas(V) depende de la presión (P), la temperatura (T) y de la cantidad o numero de moles ( n).
Las propiedades de la materia en estado gaseoso son:
 |
| Recipentes de gas. |
1. Se adaptan a la forma y el volumen del recipiente que los contiene. Un gas, al cambiar de recipiente, se expande o se comprime, de manera que ocupa todo el volumen y toma la forma de su nuevo recipiente.
2. Se dejan comprimir fácilmente. Al existir espacios intermoleculares, las moléculas se pueden acercar unas a otras reduciendo su volumen, cuando aplicamos una presión.
3. Se difunden fácilmente. Al no existir fuerza de atracción intermolecular entre sus partículas, los gases se esparcen en forma espontánea.
4. Se dilatan, la energía cinética promedio de sus moléculas es directamente proporcional a la temperatura aplicada.
Variables que afectan el comportamiento de los gases
1. PRESIÓN
Es la fuerza ejercida por unidad de área. En los gases esta fuerza actúa en forma uniforme sobre todas las partes del recipiente.
La presión atmosférica es la fuerza ejercida por la atmósfera sobre los cuerpos que están en la superficie terrestre. Se origina del peso del aire que la forma. Mientras más alto se halle un cuerpo menos aire hay por encima de él, por consiguiente la presión sobre él será menor.
2. TEMPERATURA
 |
| Volumen de un gas. |
Es una medida de la intensidad del calor, y el calor a su vez es una forma de energía que podemos medir en unidades de calorías. Cuando un cuerpo caliente se coloca en contacto con uno frío, el calor fluye del cuerpo caliente al cuerpo frío.
La temperatura de un gas es proporcional a la energía cinética media de las moléculas del gas. A mayor energía cinética mayor temperatura y viceversa.
La temperatura de los gases se expresa en grados kelvin.
3. CANTIDAD
La cantidad de un gas se puede medir en unidades de masa, usualmente en gramos. De acuerdo con el sistema de unidades SI, la cantidad también se expresa mediante el número de moles de sustancia, esta puede calcularse dividiendo el peso del gas por su peso molecular.
4. VOLUMEN
Es el espacio ocupado por un cuerpo.
5. DENSIDAD
Es la relación que se establece entre el peso molecular en gramos de un gas y su volumen molar en litros.
Gas Real
Los gases reales son los que en condiciones ordinarias de temperatura y presión se comportan como gases ideales; pero si latemperatura es muy baja o la presión muy alta, las propiedades de los gases reales se desvían en forma considerable de las de gases ideales.
Concepto de Gas Ideal y diferencia entre Gas Ideal y Real.
Los Gases que se ajusten a estas suposiciones se llaman gases ideales y aquellas que no se les llama gases reales, o sea, hidrógeno, oxígeno, nitrógeno y otros.
1. - Un gas esta formado por partículas llamadas moléculas. Dependiendo del gas, cada molécula esta formada por un átomo o un grupo de átomos. Si el gas es un elemento o un compuesto en su estado estable, consideramos que todas sus moléculas son idénticas.
2. - Las moléculas se encuentran animadas de movimiento aleatorio y obedecen las leyes de Newton del movimiento. Las moléculas se mueven en todas direcciones y a velocidades diferentes. Al calcular las propiedades del movimiento suponemos que la mecánica newtoniana se puede aplicar en el nivel microscópico. Como para todas nuestras suposiciones, esta mantendrá o desechara, dependiendo de sí los hechos experimentales indican o no que nuestras predicciones son correctas.
3. - El numero total de moléculas es grande. La dirección y la rapidez del movimiento de cualquiera de las moléculas puede cambiar bruscamente en los choques con las paredes o con otras moléculas. Cualquiera de las moléculas en particular, seguirá una trayectoria de zigzag, debido a dichos choques. Sin embargo, como hay muchas moléculas, suponemos que el gran numero de choques resultante mantiene una distribución total de las velocidades moleculares con un movimiento promedio aleatorio.
4. - El volumen de las moléculas es una fracción despreciablemente pequeña del volumen ocupado por el gas. Aunque hay muchas moléculas, son extremadamente pequeñas. Sabemos que el volumen ocupado por una gas se puede cambiar en un margen muy amplio, con poca dificultad y que, cuando un gas se condensa, el volumen ocupado por el gas comprimido hasta dejarlo en forma líquida puede ser miles de veces menor. Por ejemplo, un gas natural puede licuarse y reducir en 600 veces su volumen.
5. - No actúan fuerzas apreciables sobre las moléculas, excepto durante los choques. En el grado de que esto sea cierto, una molécula se moverá con velocidad uniformemente los choques. Como hemos supuesto que las moléculas sean tan pequeñas, la distancia media entre ellas es grande en comparación con el tamaño de una de las moléculas. De aquí que supongamos que el alcance de las fuerzas moleculares es comparable al tamaño molecular.
6. - Los choques son elásticos y de duración despreciable. En los choques entre las moléculas con las paredes del recipiente se conserva el ímpetu y (suponemos)la energía cinética. Debido a que el tiempo de choque es despreciable comparado con el tiempo que transcurre entre el choque de moléculas, la energía cinética que se convierte en energía potencial durante el choque, queda disponible de nuevo como energía cinética, después de un tiempo tan corto, que podemos ignorar este cambio por completo.
EJERCICIOS DE SOLUCIONES RESUELTOS
1. calcula el % m/m de una solución que contiene 2,5 grs. de soluto en 120 grs. de solución.
En este caso es conveniente utilizar la fórmula para porcentaje.
%m/m = (masa soluto/masa solución) x 100
%m/m = (2.5/120) x 100 Rta = 2.08 % m/m
2. Calcula la masa de soluto que hay en 460 grs. de una solución que es 5% m/m.
Aquí podemos usar la misma fórmula, simplemente tenemos que despejar la incógnita que nos piden. La masa de soluto.
Masa de soluto = (%m/m x masa de Solución)/100
Masa de soluto = (5% x 460 grs.) / 100 Rta = 23 grs.
3. Calcula el volumen que tendrá una solución que es 4% m/v y contiene 40 grs. de soluto.
La fórmula utilizada no es muy distinta, solo que aquí hablamos de volumen en lugar de masa.
% m/v = (masa de soluto/volumen de solución) x 100
De aquí despejamos el volumen de solución.
V de Solución = (masa de soluto/% m/v) x 100
V = (40grs. / 4%) x 100 Rta = 1000 cm cúbicos.
4. Calcula la masa de solvente que habrá en una solución 14% m/m de masa de 280 grs.
En primer lugar debemos encontrar la masa de soluto que hay en los 280 grs. de solución.
Masa de soluto = (Masa de solución x % m/m)/100
Masa de soluto = (280grs. x 14)/100 = 39.2 grs.
Ahora sabiendo que la masa de solución es igual a la cantidad de soluto más la cantidad de solvente solo tenemos que restarle a la masa de solución la masa de soluto y obtenemos la masa de solvente.
Masa de Solvente = 280 grs. – 39.2 grs. Rta = 240.8 grs
5. Cuál será la molaridad de una solución que contiene 64 g de Metanol (masa molar del metanol 32 gr/mol) en 500 ml de solución?
Datos conocidos: metanol 64 g
Masa molar del metanol: 32 g/mol
Masa de la solución: 500 ml (0,5 litro)
Primero calculamos la cantidad de moles que hay en 64 g de metanol.
Si un mol de metanol equivale a 32 g, 64 g equivalen a 2 moles (64/32=2)
Aplicamos la fórmula:
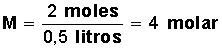
Respuesta: 4 molar
6. Se tiene un litro de solución al 37%. ¿Cuántos litros de agua se tienen que agregar para que quede al 4%?
Resolvamos:
El problema no indica las unidades físicas de concentración. Se supondrá que están expresadas en % P/V.
Datos que conocemos: V = volumen, C= concentración
V1 = 1 litro
C1 = 37%
37% P/V = significa que hay 37 gramos de soluto en 100 ml de solución (solución = soluto + solvente).
C2 = 4%
V2 = ¿?
Regla para calcular disoluciones o concentraciones
V1 • C1 = V2 • C2
Puede expresarse en: % P/V
Reemplazando los datos que se tienen del problema, se obtiene:
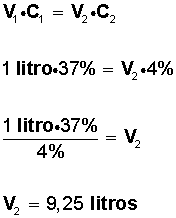
Entonces, si tenemos un litro de solución al 37%; para obtener una solución al 4% es necesario tener un volumen de 9,25 litros; por lo tanto, para saber cuantos litros de agua hay que agregar al litro inicial, hacemos:
V2 – V1 = Volumen de agua agregado
9,25 – 1 = 8,25 litros
Respuesta: Se deben agregar 8,25 litros de agua
7. Se agregan 3 gramos de sal en una cacerola con 4 litros de agua ¿cuál es la concentración de sal?, o dicho de otra forma ¿cuál es la concentración de la solución?
Calcular la fracción molar de solvente y de soluto: Recordemos que la fracción molar expresa la concentración de una solución en Moles de Soluto o de Solvente por Moles Totales de la Solución.
Solvente: agua (H2O)
Soluto: sal (NaCl)
Datos que conocemos: 3 gramos de soluto y 4.000 cm3 (4 litros) de solvente.
Con estos datos debemos resolver el problema, calculando 4 valores significativos: moles de solvente, moles de soluto, fracción molar de solvente y fracción molar de soluto.
Para el agua, se conoce su masa molar = M(H2O) = 18 g/mol (1 mol de H2O contiene 18 g, formados por 2 g de H y 16 g de O).
Averiguar cuántos moles de solvente H2O) tenemos:
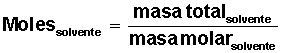
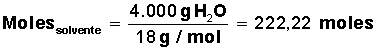
Para la sal (NaCl) su masa molar = M(NaCl) = 58,5 g/mol (1 mol de sal equivale a 58,5 g, formados por 23 g de Na y 35,5 g de Cl)
Averiguar cuántos moles de soluto tenemos:
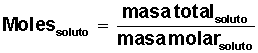
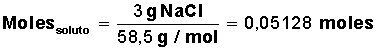
Ahora que conocemos la cantidad de moles de solvente y la cantidad de moles de soluto, podemos calcular las fracciones molares de solvente y de soluto:
Fracción molar del solvente = Xsolvente
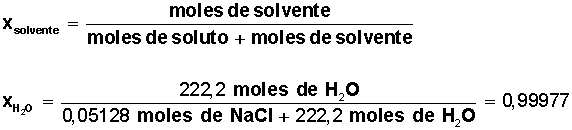
Fracción molar del solvente (agua) = 0,99977
Fracción molar del soluto= Xsoluto

Fracción molar del soluto= 0,00023
Pero sabemos que:
Entonces: 0,99977 + 0,00023 = 1
EJERCICIOS DE SOLUCIONES PARA RESOLVER
1. La glucosa, uno de los componentes del azúcar, es una sustancia sólida soluble en agua. La disolución de
glucosa en agua (suero glucosado) se usa para alimentar a los enfermos cuando no pueden comer.
En la etiqueta de una botella de suero de 500 cm3
aparece: “Disolución de glucosa en agua, concentración 55
g/l”.
a) ¿Cuál es el disolvente y cuál el soluto en la disolución?
b) Ponemos en un plato 50 cm3
. Si dejamos que se evapore el agua, ¿Qué cantidad de glucosa quedará en el
plato?
c) Un enfermo necesita tomar 40 g de glucosa cada hora ¿Qué volumen de suero de la botella anterior se le
debe inyectar en una hora?
2. En un vaso se han puesto 250 g de alcohol junto con 2 g de yodo, que se disuelven completamente.
a) Calcular la concentración de la disolución en % en masa.
b) ¿Cuántos gramos de disolución habrá que coger para que al evaporarse el alcohol queden 0,5 g de yodo
sólido?
c) Si tomamos 50 g de disolución y dejamos evaporar el alcohol. ¿Cuántos gramos de yodo quedan?
3. Hemos preparado una disolución de cloruro de cobre (Cu Cl2
) en agua disolviendo 12 g de cloruro de cobre en
98 g de agua, de forma que una vez completamente disuelta ocupa un volumen de 100 cm3
.
a) Calcula la concentración en % en peso y en g/l.
b) ¿Qué concentración tendrán 10 cm3
de esa disolución?
c) Si evaporamos todo el agua que hay en los 10 cm3
de disolución, ¿cuánto cloruro de cobre se recupera?
d) ¿Qué tendríamos que hacer para que la disolución esté más diluida?
medir la concentración de oro en una aleación (el resto suele ser plata) se usa una unidad llamada quilate. Una
concentración de 1 quilate es de 1/24 del total, es decir, de cada 24 g de aleación, 1 g es de oro puro.
a) ¿Qué % en peso corresponde a una aleación de 1 quilate?
b) ¿Qué % contendrá una aleación de 18 quilates? ¿y de 24 quilates?
c) ¿Puede existir una aleación de 30 quilates? ¿por qué?
d) ¿Qué cantidad de oro puro posee un lingote de oro de 18 quilates de 4 kg de masa?
5. El ácido clorhídrico (H Cl) de los recipientes de laboratorio se encuentra disuelto en agua, con una
concentración del 35 % en masa.
a) ¿Qué cantidad de ácido clorhídrico contendrá un recipiente de 1,5 kg de disolución?
b) ¿Qué cantidad de disolución debemos coger para que contenga 6 g de H Cl?
EJERCICIOS DE GASES CON RESPUESTA
en este link encontraras algunos ejercicios resueltos los cuales con ellos podras aprender a resolver resolver otros ejercicios
http://www.profesorenlinea.cl/fisica/GasesLeyes_Ejercicios.html
EJERCICIOS DE GASES PARA RESOLVER
en este link encontraras algunos ejercicios con los cuales podras practicar e ir aprendiendo
http://webdelprofesor.ula.ve/ciencias/chataing/Cursos/Fisicoquimica/Ejercicios/EJERCICIOS_DE_QUIMICA_No%204.pdf